
Anorganische Verbindungen
Wasser ist sehr gutes polares Lösungsmittel und löst daher polare Substanzen sehr gut.
Wasser enthält anorganische Stoffe in Ionen-Form echt gelöst, einmal positiv geladen
(Kationen) und einmal negativ geladen (Anionen)
Anorganische Verbindungen sind alle nicht-Kohlenstoff-
Verbindungen. Organische Verbindungen enthalten immer
Kohlenstoff (C).
Per Definition werden folgende Kohlenstoff-Verbindungen zu den
anorganischen Stoffen gerechnet:
Die Oxide des Kohlenstoffs (Kohlenstoffmonoxid,
Kohlenstoffdioxid), die Kohlensäure und Carbonate,
Schwefelkohlenstoff, die Carbide sowie die ionischen Cyanide,
Cyanate und Thiocyanate.
Für die Wasserchemie von Bedeutung sind hiervon Kohlendioxid
CO
2
, Kohlensäure H
2
CO
3
, Hydrogencarbonat HCO
3
-
und Carbonat
CO
3
2-
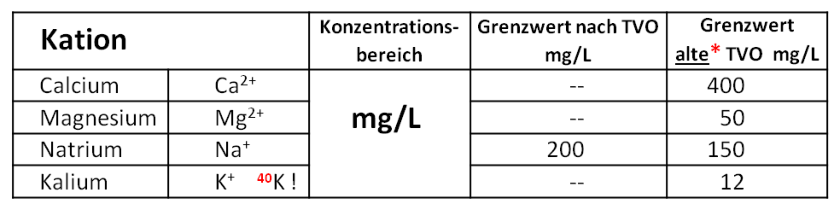
Alle weiteren Alkali- und Erdalkali-Ionen kommen nur in Spuren vor.
Ebenso
kommen
Metall-Kationen
normalerweise
nicht
in
größeren
Mengen
vor.
Reduzierte
Grundwässer
können
jedoch
erhöhte
Eisen-
und
Manganwerte
aufweisen,
wobei die Eisenwerte deutlich im Milligrammbereich liegen können.
(
40
K ist das natürliche radioaktive Isotop des Kaliums, immer als geringer Anteil enthalten)
*
Zur Orientierung sind frühere, heute
nicht mehr geltende
Grenzwerte der TVO angegeben.
(TVO = Trinkwasserverordnung)

Aber
schon
geringe
Konzentrationen
an
anderen
Metall-Kationen,
hier
besonders
auch
Schwermetall-Kationen, können wegen ihrer Toxizität bedenklich sein.
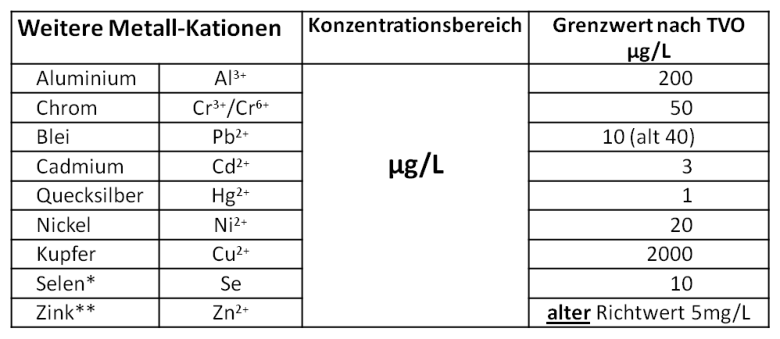
*Selen ist ein essentielles Spurenelement, in hohen Konzentration aber toxisch.
**Zink ist ein essentielles Spurenelement, alter Richtwert (frühere TVO) 5 mg/L
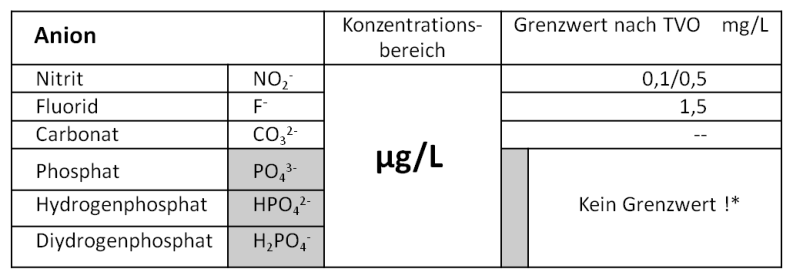
Anionen (negativ geladen)
Die häufigsten Anionen in natürlichen Wässern im Konzentrationsbereich von mg/L: Meist in geringeren Konzentrationen liegen in natürlichen Wässern vor: *Bei der Zugabe von Polyphosphat zur Korrosionsbegrenzung dürfen maximal 2,2 mg/L P (= 6,7 mg/L PO 4 3- ) zugegeben werden. Eine besondere Bedeutung haben die Hydrogencarbonat- und Carbonationen, da diese weitgehend das Pufferungsverhalten eines natürlichen Wassers bestimmen.Radioaktive Stoffe
*Der Grenzwert ist primär durch die toxische Wirkung bedingt, nicht durch die Strahlung.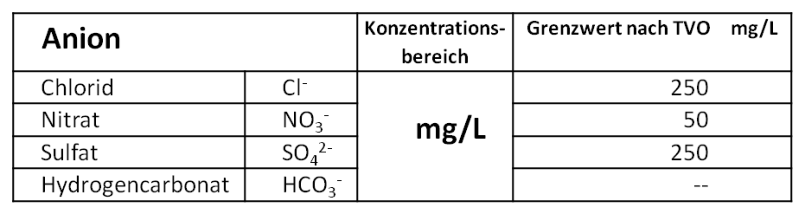

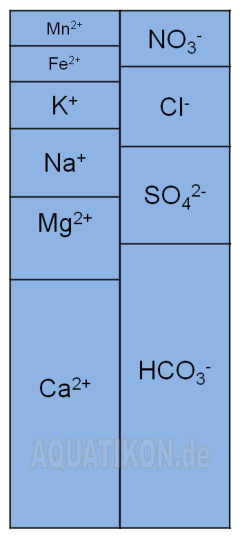
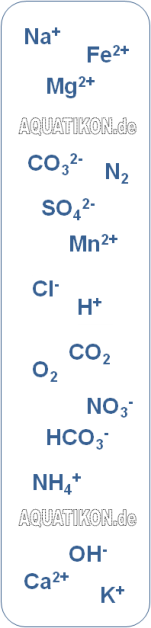
Beispielhafte Ladungsbilanz
eines Wassers
Bild: Im Wasser gelöste Kationen in höheren Konzentrationen:
Calcium, Magnesium, Natrium und Kalium
Kationen (positiv geladen)
Die häufigsten Kationen in natürlichen Wässern im Konzentrationsbereich von mg/L:Ladungsbilanz
Im Wasser liegen genau so viele negative Ladungen (Anionen) wie positive Ladungen (Kationen) vor (Elektroneutralitätsbedingung). Die Verteilung der Ladung wird durch eine Ladungsbilanz dargestellt. Die ungefähre Verteilung von Anionen und Kationen in einer Ladungsbilanz eines natürlichen Wassers sieht von der Größenordnung her folgendermaßen aus:
- Wissen über Wasser
Besondere Bedeutung:
Ammonium NH
4
+
→
Hinweis auf Zersetzungsvorgänge,
Abwassereinleitungen
Grenzwert im Trinkwasser 0,5 mg/L
Sonderrolle:
Die Kationen der Erdalkaligruppe werden auch als „Härtebildner“ bezeichnet.
(Siehe Wasserchemie/Härte)
Wasserinhaltsstoffe





