
Wasserchemie

Die
Härte
des
Wassers
(Wasserhärte)
gibt
als
Messwert
an,
wieviel
Calcium
(Ca
2+
)
und
Magnesium (Mg
2+
) im Wasser gelöst sind.
Die Angabe erfolgt normgerecht als mol/m³ bzw. mmol/L.
Nicht normgerecht, aber im Alltagsleben immer noch verbreitet, erfolgt die Angabe als Grad
deutscher Härte (°dH).
Allgemeines
Die
Härte
entsteht
beim
Auflösen
von
Mineralien.
Die
im
Wasser
gelösten
Erdalkali-Ionen
bilden
die
Härte
im
Wasser.
In
den
meisten
Wässern
sind
als
Härtebildner
nur
Calcium-
und
Magnesium-Ionen
vorhanden.
Beryllium-,
Barium-
und
Strontium-Ionen
sind
selten
und
auch
dann
nur
in
sehr
geringen
Konzentrationen
nachzuweisen.
Radium
sollte
im
Wasser
nicht vorhanden sein.
Erdalkali-Ionen
Be
2+
Mg
2+
Ca
2+
Sr
2+
Ba
2+
Ra
2+
Der
Begriff
der
Härte
ist
historisch
zu
verstehen.
Bei
der
früher
üblichen
Kleiderwäsche
mit
Seife
(Alkali-Salze
der
Fettsäuren)
bildeten
sich
die
unlöslichen
"Kalkseifen"
(Ca-Salze
der
Fettsäuren)
und
setzten
sich
in
der
Wäsche
fest.
Dieses
führte
zu
einem
Gefühl
der
Sprödigkeit und Härte bei den Kleidungsstücken.
Bei
den
heutigen
Waschmitteln
aus
künstlichen
Tensiden
(z.B.
Sulfonate)
bilden
sich
keine
unlöslichen Verbindungen, so dass dieser Aspekt der Härte entfällt.
Ein
anderer
Nachteil
der
Härte
ist
die
Abscheidung
von
CaCO
3
(Kalkstein,
Kesselstein),
wenn die Löslichkeit beim Erwärmen des Wassers überschritten wird.
Trinkwässer
haben
je
nach
Herkunft
unterschiedliche
Gehalte
an
Härtebildnern.
Dies
hängt
von der Art des Rohwassers und der Geologie des Einzugsgebietes ab.
Beispiele:
Talsperrenwasser
aus
den
sogenannten
Urgesteins-Mittelgebirgen
(Granite
und
Gneise:
z.B.
Harz,
Sauerland,
Eifel,
Schwarzwald)
ist
sehr
weich,
z.B.
<
3°dH
in
der
Eifel und im Harz.
Grundwasser
aus kalkhaltigem Gestein ist sehr hart, in der Regel über 20 °dH.
Der
Bodensee
als
großer
Trinkwasserspeicher
liefert
nach
Angaben
der
Bodensee-
Wasserversorgung ein Trinkwasser mit 9 °dH (1,61 mmol/L, Härtebereich mittel)
Definitionen
(Begriffe
wie
Gesamthärte,
Carbonathärte,
bleibende
oder
vorübergehende
Härte
sind
veraltet und sollten nicht mehr verwendet werden!)
Härte
=
Summe
der
Stoffmengenkonzentrationen
der
Calcium-
und
Magnesium-Ionen
im
Wasser
Härte = c(Ca
2+
) + c(Mg
2+
)
[mol/m³] bzw. [mmol/L]
Historische Definition des Härtegrades:
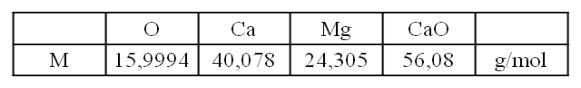
1° dH = 10 g/m³ CaO ( °dH = Grad deutscher Härte)
Umrechnungen:
mit M(CaO)=56,08 g/mol → 1 mol/m³ = 5,6 °dH → 1°dH = 0,179 mol/m³
In anderen Ländern gelten andere Definitionen, z.B. Französische Härte
1 °fH = 10 g CaCO
3
/ m³ 1 mol/m³ = 10 °fH (°fH = Grad französischer Härte)
Allgemein gelten 30 °dH als obere Grenze für Trinkwässer.
Angabe der Ergebnisse
Die
nach
dem
SI-System
vorgeschriebene
Einheit
zur
Angabe
des
Ergebnisses
ist
mol/m
3
(auch
mmol/L).
Im
amtlichen
Verkehr
nicht
mehr
zugelassen,
aber
in
der
Praxis
nach
wie
vor in Gebrauch: Deutscher Härtegrad (°dH)
Berechnung der Wasserhärte
Beispiel-Berechnung →Wasser - Härte

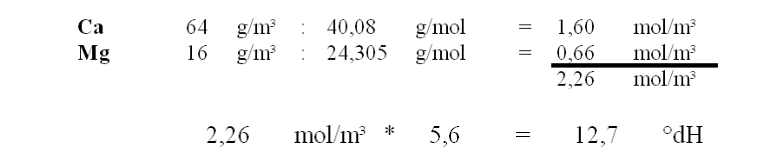
(Zentrale Enthärtung / Entcarbonisierung findet man im Hauptmenü unter Wasseraufbereitung)






Was ist die Härte im Wasser
AQUATIKON

- Wissen über Wasser


